研究内容
はじめに
ミトコンドリアとオートファジー
ミトコンドリアは、細胞小器官 (オルガネラ) という細胞を構成する構造体の一つで、摂取した栄養を ATP (アデノシン三リン酸) という細胞が使いやすいエネルギーに変換する役割があります。発電所が、石油、石炭、ガス、原子力など取り扱いにくいエネルギーの塊から、電灯からパソコンまで何にでも使える「電気」という使いやすいエネルギーに変換し、各家庭に送り届けるように、ミトコンドリアは、食物から得た糖や脂肪などの栄養を単一の ATP に変換し、細胞内に送り届けます。このミトコンドリアで産生された ATP を用いて、細胞は様々な活動ができるようになります。例えば、筋肉を動かすのも、頭を使って考え事をするのもミトコンドリアが作った ATP を利用しています。
このように、ミトコンドリアは細胞が活動する上で必須のオルガネラですから、多くの研究者の興味を引きつけ、多くの研究が行われてきました。その中には、1978 年ノーベル化学賞受賞者ピーター・ミッチェルによる化学浸透圧説や、1997 年ノーベル化学賞受賞者ポール・ボイヤーとジョン・E・ウォーカーの ATP 合成酵素の研究など、多くの素晴らしい研究が含まれています。このような研究の結果、現在では、食べた栄養がミトコンドリアの中でどのように ATP に変換されるのか、かなり詳しく解明されています。また、最近の分子生物学の発展により、ミトコンドリアがどのように作られているのか、つまりミトコンドリアを構成する成分がどこで作られ、どのようにミトコンドリア内に運び込まれるのかも詳しく知られるようになりました。このように、これまで多くの研究者を惹きつけ、現在はさらに盛んに研究されるようになっているミトコンドリアですが、未だにほとんど解明されていない事があります。それが、私たちの研究テーマである「ミトコンドリアの分解」です。
どのような物でも同じですが、例えば上記で例に用いた発電所の場合では、電力の需要に応じて発電所は新しく作られ、働き (発電すること)、古くなれば壊して新しいものに作り替えられます。電力の需要が減れば、壊すだけで新たに作らないということもあるでしょう。ミトコンドリアの場合も同じだと考えられます。私たちの体を構成している細胞の一部は、例えば神経細胞などは、100 歳の方なら 100 年間も同じ細胞が使われています。この中にあるミトコンドリアも 100 年間、入れ替わりが起こっていないとはとても考えられません。必ず壊して、新しいものに作り替えられているはずです。しかしながら、これまでミトコンドリアを壊すことに関しては、ほとんど研究されていませんでした。少し前までは、ミトコンドリアのような大きなオルガネラを分解する機構が存在するとは考えられなかったのだと思います。このミトコンドリアを分解する機構は、ミトコンドリアオートファジーまたはマイトファジーと呼ばれています。私たちは、様々な研究を通じてマイトファジーの存在を証明し、その分子機構の大部分を解明してきました (私たちの研究成果を参照)。マイトファジーのことは、後で詳しく説明するとして、まずはオートファジーについてです。
オートファジーとは
オートファジーは、自食作用と訳されるように、細胞がタンパク質やオルガネラを細胞内で消化・分解する現象です。このオートファジーは、ほとんどの真核生物に見られる現象で、細胞が生きていくために重要な役割を持っています。私たちヒトでも、パンを焼いたりワインを作ったりする時に使われる酵母と呼ばれる単細胞生物でも、栄養が摂取できなくなるとオートファジーが強く誘導されます。誘導されたオートファジーにより、細胞内のタンパク質やオルガネラが分解され、新しくアミノ酸や脂質などに変わります。この新しくできたアミノ酸などを使って、細胞は栄養が無い環境下で生き延びるのに必要なタンパク質を作り出し、危機を乗り越えようとします。
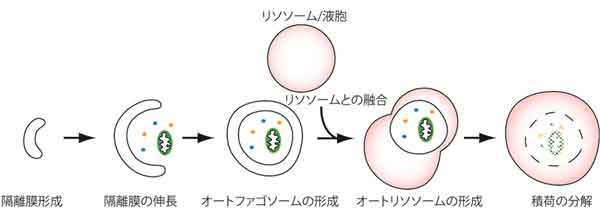
下図はオートファジーの模式図です。オートファジーが誘導されると隔離膜と呼ばれる脂質二重膜が細胞質内に現れ、伸長し、タンパク質やオルガネラなどの細胞質成分を包み込みます。完全に包み込んだ状態をオートファゴソームと呼びます。次に、このオートファゴソームがリソソーム (酵母の場合は液胞と呼ばれる) と融合します (正確にはオートファゴソームの外膜とリソソーム膜が融合します)。リソソーム内は酸性で、加水分解酵素で満たされており、これらの酵素により取り込まれた細胞質成分が分解されます。
このような過程を経て、細胞質成分を分解するのがオートファジーです。オートファジーは、電子顕微鏡観察などにより 1960 年代からその存在は知られていましたが、1990 年代に入るまでほとんど研究されることはありませんでした。1990 年代になって、大隅良典先生らが酵母を用いた実験により、オートファジーに必須な遺伝子群 (ATG 遺伝子) を同定したことを皮切りに研究が大きく前進し、現在ではオートファジーが分子機構レベルで解明されるに至っています。大隅先生は、オートファジーの仕組みの解明により、2016 年にノーベル生理学・医学賞を受賞されました。
ミトコンドリアオートファジーと健康
ミトコンドリアオートファジー (マイトファジー)
一般的にオートファジーは、細胞質のタンパク質やオルガネラを非選択的に分解する現象です。しかしながら、研究が進むにつれて、オートファジーにはミトコンドリアやペルオキシソーム、小胞体などを他の細胞質成分から選択して分解する機能が備わっていることが明らかとなってきました。分解対象を選択して分解するオートファジーは選択的オートファジーと呼ばれています。選択的オートファジーの中でも、私たちが研究対象としているのが、「オートファジーによる選択的ミトコンドリア分解」、すなわちマイトファジーです。
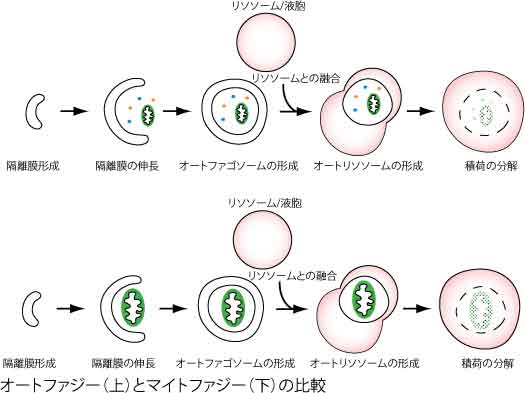
マイトファジーもオートファジーの一種ですから、ミトコンドリアを分解する過程の多くは、オートファジーと共通です。下図にオートファジーとマイトファジーの模式図を示しますが、オートファジーとの大きな違いは、「隔離膜が分解対象としてミトコンドリアを選択しているかどうか」ということです。それ以外は、ほとんど同じと言えるかもしれません。実際、私たちが酵母で試したところ、オートファジーに必要な遺伝子 (ATG遺伝子) の全てがマイトファジーにも必要であるが、ミトコンドリアの選択に関わる部分のみがマイトファジー特有の遺伝子であるという結果でした (Kanki and Klionsky, J Biol Chem, 2008)。哺乳類の培養細胞でも、オートファジーに必要な遺伝子のほとんどはマイトファジーにも必要なようです。
マイトファジーと健康
私たちの研究成果
選択的なミトコンドリア分解は本当に存在するのか? その分子機構は?
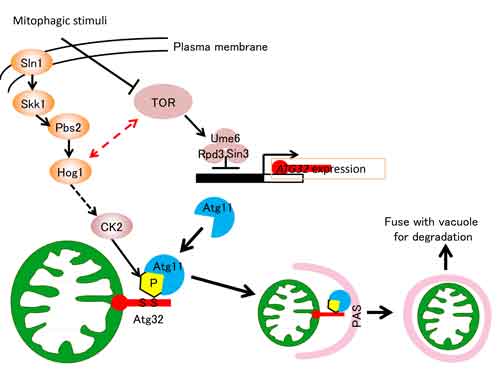
酵母におけるマイトファジーの意義
哺乳類におけるマイトファジー
酵母では Atg32 を中心としたミトコンドリア選択的分解機構を明らかにしてきたのですが、哺乳類では、未だにどのようにしてオートファジーがミトコンドリアを分解しているのか明らかになっていません。残念なことに、Atg32 のホモログは、哺乳類には存在しないようです。さらに、哺乳類ではマイトファジーを観察するのが困難なことが研究をさらに難しくしています。
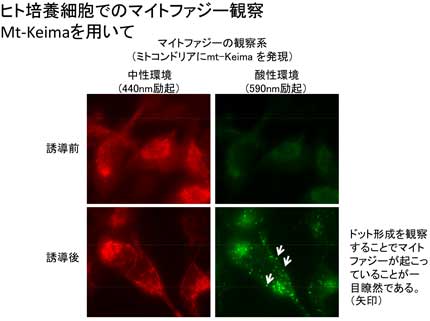
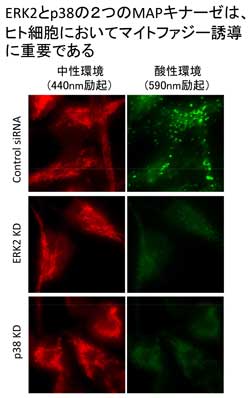
私たちは、哺乳類におけるマイトファジー研究を進めていくために、高感度なマイトファジー観察法を確立しました。これは蛍光タンパク質 Keima を用いる方法で、理化学研究所の片山先生・宮脇先生らが開発された方法です (Katayama et al., Chem Biol, 2011)。この方法を用いてマイトファジーを観察したところ (下図左)、まずは、哺乳類細胞でも酵母と同様に p38 と Erk2 の MAP キナーゼシグナル経路が関わっていることが判明しました (下図右、Hirota et al., Autophagy, 2015)。p38 は、酵母の Hog1 に相当する MAP キナーゼですから、哺乳類には Atg32 ホモログが存在しないとしても、哺乳類と酵母の間でマイトファジーの誘導シグナルは共有されていそうです。我々は、培養細胞系を用いてマイトファジーの研究を進めていますし、新たにマウスモデルも導入して、マイトファジーの生理的意義や疾患との関わりにまで踏み込んで研究を進めているところです。
研究成果のプレスリリース
上記の研究成果をもとにさらに研究を発展させ、マイトファジーの抑制機構の解明、新規マイトファジーレセプター Atg43 の同定、新規ミトコンドリア分裂様式の発見とその責任因子 Atg44/マイトフィッシンの同定、マイトファジーモニターマウスの作製、廃用性筋委縮におけるマイトファジーの解析、鉄依存性細胞死フェロトーシスの制御におけるマイトファジーの役割、など様々な論文を発表してきました。その中から、プレスリリースを行った研究成果を紹介します。
ミトコンドリア分裂を促進する新しい因子を発見
Furukawa et al., EMBO Rep (2026)*
オートファジーによるミトコンドリア分解の仕組みとその微細構造を解明~隔離膜はミトコンドリアに密着して伸長する~
Yamashita et al., J Cell Biol (2025)*
ミトコンドリア分裂の必須因子を発見 ~狭窄後のトドメが分裂の決め手~
Furukawa et al., Autophagy (2024)*
マイトファジーが細胞死を抑制 ~鉄依存性細胞死フェロトーシスの制御におけるマイトファジーの役割を解明~
Yamashita et al., Cell Death Differ (2024)*
神経系を起点とするオートファジー・寿命制御ネットワークを解明 ~神経系のMML-1が全身の老化を制御する~
Shioda et al., Proc Natl Acad Sci USA (2023)
新規ミトコンドリア分裂因子を発見 ~マイトファジーの過程におけるミトコンドリア分裂のメカニズムを解明~
Fukuda, Furukawa, Maruyama et al., Mol Cell (2023)*
ヒトパレコウイルスが細胞へ侵入し感染するために必要な細胞膜蛋白質を同定
Watanabe, Oka, Takagi et al., Nat Commun (2023)
糖尿病におけるミトコンドリア品質管理の重要性を発見~新治療薬の可能性
Aoyagi et al., Diabetologia (2022)
使われない筋肉の萎縮過程におけるオートファジーによるミトコンドリア分解の増加を発見
Yamashita, Kyuuma, Inoue et al., J Cell Physiol (2021)*
オートファゴソームを効率よく作る仕組みを発見 ~オートファジーの主役の働きが明らかに~
Maruyama, Alam et al., Nat Struct Mol Biol (2021)
細胞が栄養状態に応じてタンパク質の合成・分解を調節する仕組みを解明
Fukuda et al., eLife (2021)
ミトコンドリアオートファジーの制御機構を解明
Innokentev, Furukawa et al., eLife (2020)*
オートファジーによるミトコンドリアの分解を促進する新しい因子を発見
Fukuda et al., eLife (2020)*
ミトコンドリアオートファジーを抑制する新しい制御因子を発見
Furukawa et al., Cell Rep (2018)*
ミトコンドリアオートファジーの真の姿を発見! オートファジーは大きなミトコンドリアに直接かぶりつく
Yamashita et al., J Cell Biol (2016)*
*当研究室主体の研究成果
研究成果のメディア報道
メディア報道された研究成果を紹介します。
Discovery of novel mitochondrial fission factor by Niigata University group: Clarification of mechanism in mitophagy and aims for treatment of related diseases
Science Japan 2023年6月23日
新規ミトコンドリア分裂因子を発見 新潟大グループ、関連疾患治療目指す マイトファジー時の分裂メカニズム解明
科学新聞 2023年5月26日
A new reporter mouse line to detect mitophagy changes during muscle tissue loss
EurekAlert! AAAS News Release 2021年6月15日
ミトコンドリアの恒常性維持 「マイトファジー」制御機構解明 ~新潟大グループが成果~
科学新聞 2021年1月1日
ミトコンドリアの自食作用・特定酵素が抑制 ~新潟大など仕組み解明~
日本経済新聞 2018年6月21日
ミトコンドリア ~分解の仕組み一端解明~
新潟日報 2016年12月9日
オートファジー ~新たな過程発見~
朝日新聞 2016年12月8日

